Phương pháp giải các dạng bài bác tập chương Nguyên tử
Với phương thức giải những dạng bài bác tập chương Nguyên tử Hoá học tập lớp 10 tổng hợp các dạng bài xích tập, bài tập trắc nghiệm tất cả lời giải chi tiết với đầy đủ phương pháp giải, lấy ví dụ như minh họa để giúp học sinh ôn tập, biết phương pháp làm dạng bài tập Nguyên tử từ đó đạt điểm cao trong bài bác thi môn Hoá học lớp 10.
Bạn đang xem: Các dạng bài tập hóa 10 chương 1

Bài tập trắc nghiệm
Xác định nguyên tố phụ thuộc số hạt
A. Phương pháp & Ví dụ
Nguyên tử của mỗi nguyên tố có một vài Z đặc thù nên để khẳng định nguyên tố ta cần xác định Z thông qua việc lập với giải phương trình về số hạt.
a) Dạng toán cơ bạn dạng cho 1 nguyên tử
Phương pháp:
- căn cứ vào Z sẽ khẳng định được nguyên tử sẽ là thuộc nguyên tố chất hóa học nào
- giữ ý: Z = số proton (p) = số electron (e) = E
Số khối: A = Z + N
Tổng số phân tử = 2.Z + N
tổng thể hạt mang điện = Z + E = 2Z
Ví dụ 1: Tổng số hạt cơ bạn dạng của 1 nguyên tử X là 82, trong những số ấy tổng số hạt có điện nhiều hơn số hạt không mang điện là 22. Vậy X là
Hướng dẫn:
Ta có: 2.Z + N =82
2.Z - N=22
➢Z = (82+22)/4 =26
➢X là Fe
Công thức áp dụng nhanh: Z = (S + A )/4
Trong đó:
Z: số hiệu nguyên tử
S: tổng số hạt
A: Hiệu số hạt sở hữu điện cùng không mang điện
b) Dạng toán áp dụng cho hỗn hợp các nguyên tử
Phương pháp:
Nếu là Mx
Yy thì hoàn toàn có thể coi bao gồm x nguyên tử M và y nguyên tử Y.
Do đó x.ZX + y.ZY = (Sphân tử + Aphân tử) / 4
Ví dụ 2: Tổng số hạt cơ bản trong phân tử X tất cả công thức là M2O là 140, trong phân tử X thì toàn bô hạt với điện nhiều hơn thế số hạt không mang điện là 44. Vậy X là
Hướng dẫn:
Trong X bao gồm 2 nguyên tử M với 1 nguyên tử O.
Nên ta tất cả : 2.ZM + 8 = (140 + 44) : 4 = 46 &r
Arr; Z =19
&r
Arr; M là K &r
Arr; X là K2O
Áp dụng mở rộng công thức bên trên trong giải ion
➢ nếu như ion là Xx+thì ZX = (S + A+ 2x) / 4
➢ giả dụ ion Yy-thì ZY = (S + A – 2y) / 4
Vậy khác biệt của bí quyết này với công thức ban đầu đó là thêm cực hiếm của năng lượng điện ion
Cách nhớ: trường hợp ion dương thì rước + 2 lần giá trị năng lượng điện ion dương, nếu âm thì – 2 lần giá trị điện ion âm)
Ví dụ 3: Tổng số hạt cơ phiên bản của ion M3+ là 79, trong những số ấy tổng số hạt mang điện nhiều hơn thế nữa không mang điện là 19. M là
Hướng dẫn:
ZM = (79 + 19 +2.3) : 4 = 26 &r
Arr; M là fe (Fe).
c) Dạng toán cho tổng số phân tử cơ bản
Phương pháp:
Với dạng này thì ta phải phối hợp thêm bất đẳng thức:
1 ≤ N/Z ≤ 1,52 (với 82 yếu tắc đầu bảng tuần hoàn)
1 ≤ (S −2Z)/Z ≤ 1,52 &r
Arr; S/3,52 ≤ Z ≤ S/3
Thường với cùng một số yếu tắc đầu độ chênh lệch giữa p, n, rất hiếm thường là một trong hoặc 2, nên sau khoản thời gian chia S cho 3 ta thường chon luôn giá trị nguyên ngay gần nhất.
Ngoài ra rất có thể kết thích hợp công thức:
S = 2Z + N = Z + (Z + N) xuất xắc là S =Z + A
Ví dụ 4: Tổng số phân tử cơ bản của nguyên tử X là 52, X thuộc nhóm VIIA. X là
Hướng dẫn:
Z ≤ 52: 3 = 17,33 &r
Arr; Z là Clo (Cl)
ZM ≤ 60:3 = 20 &r
Arr; Ca, ZX ≤ 24 : 3 = 8 &r
Arr; O Vậy MX là Ca
O.
B. Bài xích tập trắc nghiệm
Câu 1. cho nguyên tử X tất cả tổng số hạt là 34, trong những số ấy số hạt có điện cấp 1,8333 lần số hạt không có điện. Xác minh số khối X?
A. 23 B. 24 C. 27 D. 11
Lời giải:
Đáp án: A
Ta bao gồm tổng số hạt trong nguyên tử: phường + N + E = 34
Mà p = E = Z &r
Arr; 2Z + N = 34
Mặt không giống số hạt với điện gấp 1,8333 lần số hạt không có điện nên:
2Z = 1,8333N &r
Arr; 1,8333N + N = 34 &r
Arr; N = 12 &r
Arr; Z = 11
Vậy X có Z = 11 buộc phải điện tích hạt nhân là 11+
Số khối của X: A = Z + N = 23
Câu 2. Một nguyên tử thành phần A bao gồm tổng số proton, nơtron, electron là 52. Tìm kiếm nguyên tố A.
A. Mg B. Cl C. Al D. K
Lời giải:
Đáp án: B
Ta có: 2Z + N = 52
Do câu hỏi có nhị ẩn dẫu vậy chỉ gồm một dữ kiện nhằm lập phương trình đề xuất ta sử dụng thêm giới hạn
1 ≤ N/Z ≤ 1,222 hay 52/3,222 ≤ Z ≤ 52/3 &r
Arr; 16,1 ≤ Z ≤ 17,3.
Chọn Z = 17 &r
Arr; N = 18 &r
Arr; A = 35 (nguyên tố Clo)
Câu 3. Nguyên tử của yếu tắc X tất cả tổng số hạt là 40 .Tổng số hạt với điện nhiều hơn nữa tổng số hạt không sở hữu điện là 12 hạt. Yếu tố X bao gồm số khối là :
A. 27 B. 26 C. 28 D. 23
Lời giải:
Đáp án: A
p + n + e = 40 vì phường = e &r
Arr; 2p + n = 40 (1)
Hạt sở hữu điện: phường + e = 2p
Hạt không với điện: n.
Theo bài: 2p – n = 12(2)
Từ 1 và 2 &r
Arr; p. = e = 13; n = 14 &r
Arr; A = p. + n = 27
Vậy, kim loại X là Ca, Y là Fe.
Câu 4. Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X cùng Y là 142, trong số đó tổng số hạt mang điện nhiều hơn thế nữa tổng số phân tử không với điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn thế nữa của X là 12. Hai kim loại X, Y theo lần lượt là
A. Na, K.B. K, Ca.C. Mg, Fe.D. Ca, Fe.
Lời giải:
Đáp án: D
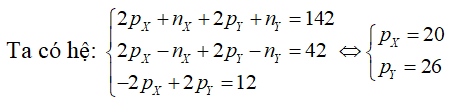
Câu 5. Tổng số phân tử proton, nơtron cùng electron trong nguyên tử thành phần X là 155, trong những số đó số hạt mang điện nhiều hơn thế số hạt không với điện là 33 hạt. X là nguyên tố nào dưới đây ?
A. Al
B. Fe
C. Cu
D. Ag
Lời giải:
Đáp án: D
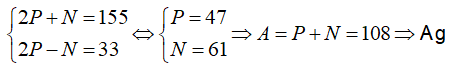
Câu 6. Một ion X3+ có tổng số hạt proton, nơtron, electron là 79, trong những số đó số hat mang điện nhiều hơn thế nữa số hạt không sở hữu điện là 19. Viết kí hiệu của nguyên tử X.
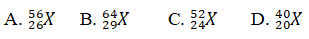
Lời giải:
Đáp án: A
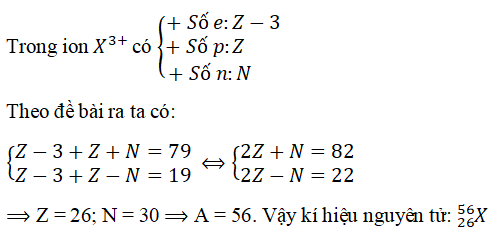
&r
Arr; Z = 26; N = 30 &r
Arr; A = 56. Vậy ki hiệu nguyên tử: 2656)X
Câu 7. Tổng số các hạt trong nguyên tử M là 18. Nguyên tử M bao gồm tổng số hạt với điện gấp rất nhiều lần số hạt không sở hữu điện. Hãy viết kí hiệu nguyên tử M.
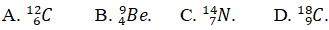
Lời giải:
Đáp án: A
Tổng số phân tử trong nguyên tử : phường + N + E = 18
Mà p. = E = Z &r
Arr; 2Z + N = 18
Măt khác tổng số hạt có điện gấp đôi số phân tử không sở hữu điện
2Z = 2N &r
Arr; Z = N = 6 &r
Arr; A = 12
Kí hiệu nguyên tử M: 612C.
Câu 8. từng phân tử XY2 bao gồm tổng những hạt proton, nơtron, electron bởi 178; trong đó, số hạt sở hữu điện nhiều hơn thế nữa số phân tử không mang điện là 54, số hạt sở hữu điện của X ít hơn số hạt với điện của Y là 12. Hãy xác định kí hiệu hoá học tập của X,Y theo lần lượt là
A. Fe với SB. S và OC. C với OD. Pb và Cl
Lời giải:
Đáp án: A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX , Y là ZY ; số nơtron (hạt không có điện) của X là NX, Y là NY . Với XY2 , ta có các phương trình:
tổng số phân tử của X với Y là: 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
Số hạt mang điện nhiều hơn thế không sở hữu điện là: 2.ZX + 4.ZY - NX – 2.NY = 54 (2)
Số hạt mang điện của X ít hơn số hạt với điện của Y là: 4.ZY – 2.ZX = 12 (3)
ZY = 16 ; ZX = 26
Vậy X là sắt, Y là diêm sinh &r
Arr; XY2 là Fe
S2
Xác định nguyên tố nguyên tử
A. Cách thức & Ví dụ
Lý thuyết và phương thức giải
- nhờ vào kí hiệu nguyên tử ra suy ra số phân tử mỗi các loại trong nguyên tử hoặc dựa vào kết cấu của nguyên tử, ion tương ứng để lập phương trình, giải phương trình kiếm tìm số hạt.
Lưu ý: Kí hiệu nguyên tử: ZAX
Sơ đồ: M → Mn+ + ne (với n là số electron vì chưng M nhường)
X + me → Xm- ( cùng với m là số electron bởi vì X nhận)
Ví dụ minh họa
Ví dụ 1. Nguyên tử Ca có 20 notron, 20 proton. Số hiệu nguyên tử của Ca là:
A. Trăng tròn B. 16 C. 31 D. 30
Hướng dẫn:
Số hiệu nguyên tử Z chính là số proton.
Đáp án A
Ví dụ 2. cho biết thêm nguyên tử của yếu tắc A bao gồm tổng số hạt là 58, số khối của nguyên tử nhỏ hơn 40. Hãy xác định số proton, số nơtron, số electron trong nguyên tử.
Hướng dẫn:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3&r
Arr; 18 ≤ Z ≤ 19,3 &r
Arr; Z = 18; Z = 19
Nếu Z = 18 &r
Arr; N = 22 &r
Arr; A = 40 (loại)
Nếu Z = 19 &r
Arr; N = 20 &r
Arr; A = 39 (nhận)
⇒ Nguyên tử A bao gồm 19p, 19e, 20n.
Ví dụ 3. hạt nhân của nguyên tử nguyên tố A tất cả 24 hạt, trong các số ấy số phân tử không mang điện là 12. Tính số electron vào A.
A. 12 B. 24 C.13 D. 6
Hướng dẫn:
Số khối A = Z + N =24
Biết N = 12 &r
Arr; E = Z = 24 - 12 = 12
Ví dụ 4. Nguyên tử X bao gồm ký hiệu 2964X. Số notron vào X là:
Hướng dẫn:
2964X &r
Arr; Z = 29, A = 64 phải N = A - Z = 64 - 29 = 35 hạt
B. Bài bác tập trắc nghiệm
Câu 1. Nguyên tử X có 35 proton, 35 electron, 45 notron. Số khối của nguyên tử X là:
A. 80 B.105 C. 70 D. 35
Lời giải:
Đáp án: A
Số khối A = Z + N = 35 + 45 = 80
Câu 2. Xác định số notron vào nguyên tử oxi biết O có 8 proton:A.8 B. 16 C.6 D.18
Lời giải:
Đáp án: A
Số proton: Z = A – N = 16 – 8 = 8
Câu 3. Trong nguyên tử A, số hạt có điện tích dương là 13, số hạt không sở hữu điện là 14. Số phân tử electron vào A là bao nhiêu?
A. 13 B. 15 C. 27 D.14
Lời giải:
Đáp án: A
Số e = Số p = 13.
Câu 4. Trong anion X3- tổng số các hạt 111; số electron bằng 48% số khối. Kiếm tìm số proton, số electron, nơtron và tìm số khối A của X3-.
Lời giải:
Đáp án:
Từ X + 3e → X3-nên tổng số phân tử trong X là: 111 – 3 = 108
Ta gồm 2Z + N = 108(1)
Mặt khác vì chưng số electron bởi 48% số khối nên:
Z + 3 = 48%(Z + N) &h
Arr; 52Z + 300 = 48N xuất xắc 13Z + 75 = 12N(2)
Từ (1) với (2) &r
Arr; Z = 33; N = 42 &r
Arr; A = 33 + 42 =75
X + me → Xm- ( với m là số electron vì chưng X nhận)
Câu 5. Cho biết nguyên tử của nguyên tố A có tổng số hạt là 58, số khối của nguyên tử nhỏ hơn 40. Hãy xác minh số proton, số nơtron, số electron trong nguyên tử.
Lời giải:
Đáp án:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3&r
Arr; 18 ≤ Z ≤ 19,3 &r
Arr; Z= 18; Z = 19
Nếu Z = 18 &r
Arr; N = 22 &r
Arr; A = 40 (loại)
Nếu Z = 19 &r
Arr; N = 20 &r
Arr; A = 39 (nhận)
&r
Arr; Nguyên tử A gồm 19p, 19e, 20n.
Câu 6. Tổng số hạt có điện vào hợp hóa học AB là 40. Số hạt sở hữu điện trong nguyên tử nguyên tử A nhiều hơn số hạt mang điện vào nguyên tử B là 8. Số proton của A và B thứu tự là
A. 22 cùng 18B. 12 cùng 8C. 20 và 8D. 12 cùng 16
Lời giải:
Đáp án: B
Tổng số hạt có điện trong hợp chất AB là 40 → 2p
A + 2p
B = 40
Số hạt sở hữu điện trong nguyên tử nguyên tử A nhiều hơn số hạt mang điện vào nguyên tử B là 8 → 2p
A - 2p
B = 8
Giải hệ → p
A = 12, p
B = 8
Câu 7. Một ion X2+ bao gồm tổng số hạt proton, nơtron, electron là 92, trong đó số hạt có điện nhiều hơn nữa số phân tử không có điện là 20. Số phân tử nơtron cùng electron vào ion X2+ theo lần lượt là
A. 36 cùng 27. B. 36 và 29 C. 29 với 36. D. 27 với 36.
Lời giải:
Đáp án: A
Giải hệ
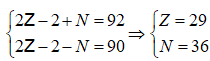
X có 29e thì dường 2e được X2+ còn 27e , số notron không đổi
Câu 8. xác định thành phần cấu tạo của những nguyên tử sau:
a. Nguyên tử X gồm tổng số những loại hạt bởi 52, trong các số đó số hạt với điện nhiều hơn thế số phân tử không sở hữu điện là 16 hạt.
b. Nguyên tử Y gồm tổng số các hạt là 36. Số phân tử không mang điện thì bởi một nửa hiệu số giữa tổng số phân tử với số hạt mang điện tích âm?
Lời giải:
Đáp án:
a) gọi p, n với e thứu tự là số pronton, nơtron, với electron của X.
Theo đề bài, ta tất cả hệ phương trình:
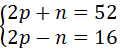
Giải hệ phương trình ta được: phường = 17, n = 18.
Vậy vào X có: 17 electron và 18 nơtron.
b) điện thoại tư vấn p, n và e theo thứ tự là số pronton, nơtron, cùng electron của Y.
Theo đề bài, ta tất cả hệ phương trình:
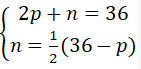
Giải hệ phương trình ta được: p = 12, n = 12.
Xem thêm: Mách Chị Em 15 Cách Trị Viêm Ngứa Phụ Khoa Đơn Giản Và Hiệu Quả
Vậy vào X có: 12 proton,12 electron với 12 nơtron
Cách viết cấu hình electron
A. Cách thức & Ví dụ
Lý thuyết và cách thức giải
- cố chắc biện pháp viết cấu hình electron nguyên tử dựa vào nguyên lý vững vàng bền, nguyên tắc Pauli cùng quy tắc Hund:
+ Nguyên lý Pauli: Trên một obital nguyên tử chỉ hoàn toàn có thể chứa tối đa là hai electron và hai electron này hoạt động tự quay không giống chiều nhau bao phủ trục riêng biệt của mỗi electron.
+ Quy tắc Hund: Trong và một phân lớp, những electron sẽ phân bổ trên các obital sao để cho số electron đơn lẻ là buổi tối đa và những electron này phải bao gồm chiều từ bỏ quay giống nhau.
+ nguyên tắc vững bền: Ở tinh thần cơ bản, vào nguyên tử các electron thứu tự chiếm các obital tất cả mức tích điện từ thấp cho cao
* công việc viết cấu hình electron nguyên tử
+ xác minh số electron trong nguyên tử.
+ Phân bố các electron theo đơn nhất tự mức tích điện AO tăng dần.
+ Viết thông số kỹ thuật electron theo máy tự những phân lớp electron trong một lớp.
Ví dụ: 26Fe.
+ có 26e
+ Viết theo chưa có người yêu tự mức tích điện AO tăng dần:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
+ sau đó viết lại theo vật dụng tự các phân lớp electron trong 1 lớp:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
+ Viết gọn:
* Chú ý:
+ đơn nhất tự các mức tích điện AO tăng đột biến như sau:
1s 2s 2p 3s 3p 4s 3 chiều 4p 5s 4 chiều 5p 6s 4f 5d 6p 7s 5f 6d 7p
+ Dạng (n – 1)d4ns2 gửi thành (n – 1)d5ns1
(n – 1)d9ns2 chuyển thành (n – 1)d10ns1
* nhờ vào số electron ở lớp ngoài cùng để suy ra đặc thù của nguyên tố hóa học.
| Số electron lớp ngoài cùng | Tính chất của nguyên tố |
| 1, 2, 3 | Kim loại |
| 4 | Kim một số loại hoặc phi kim |
| 5, 6, 7 | Phi kim |
| 8 | Khí hiếm |
Sơ đồ xuất hiện ion nguyên tử:
M → Mn+ + ne
X + me → Xm-.
Ví dụ minh họa
Ví dụ 1: cho biết số electron về tối đa trong một lớp, 1 phân lớp
Hướng dẫn:
*Số electron tối đa vào một phân lớp
+ Phân lớp s chứa tối đa 2e
+ Phân lớp p. Chứa tối đa 6e
+ Phân lớp d chứa về tối đa 10e
+ Phân lớp f chứa buổi tối đa 14e
* Số electron về tối đa trong một lớp
+ Lớp thứ nhất có tối đa 2e
+ Lớp vật dụng hai bao gồm tối đa 8e
+ Lớp thứ ba có buổi tối đa 18e
Ví dụ 2: Nguyên tử X bao gồm ký hiệu 2656X. Cho những phát biểu sau về X:
(1) Nguyên tử của thành phần X gồm 8 electron ở phần bên ngoài cùng.
(2) Nguyên tử của thành phần X gồm 30 nơtron trong hạt nhân.
(3) X là một trong những phi kim.
(4) X là yếu tắc d.
Trong những phát biểu trên, hầu hết phát biểu đúng là?
A. (1), (2), (3) cùng (4).
B. (1), (2) với (4).
C. (2) với (4).
D. (2), (3) cùng (4).
Hướng dẫn:
Do gồm sự chèn nấc NL nên electron được phân bố như sau:
1s22s22p63s23p6 4s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay
-Số e lớp ngoài cùng là 2 cho nên X là Kim loại
-N = A – Z = 56 – 26 = 30
-Electron sau cùng phân cha trên phân lớp 3d nên X là thành phần d.
&r
Arr; lựa chọn C.
Ví dụ 3: thông số kỹ thuật electron của nguyên tử nhân tố X có dạng
A. X nghỉ ngơi ô số 15 vào bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của yếu tắc X tất cả 9 electron p.
D. Nguyên tử của nhân tố X tất cả 3 phân lớp electron.
Hướng dẫn:
&r
Arr; chọn C.
Ví dụ 4: thông số kỹ thuật electron nào sau đây viết sai?
A. 1s22s22p5
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p64s24p5
D. 1s22s22p63s23p63d34s2
Hướng dẫn:
Cấu hình 1s22s2p63s23p64s24p5 thiếu thốn phân lớp 3d. Trước lúc electron được điền vào phân lớp 4p yêu cầu điền vào phân lớp 3d.
&r
Arr; chọn C.
Ví dụ 5: Một nguyên tử của thành phần X có 3 lớp electron. Phần ngoài cùng có 4 electron. Xác minh số hiệu nguyên tử của X. Viết thông số kỹ thuật e của X
Hướng dẫn:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Ví dụ 6: Một nguyên tố d có 4 lớp electron, phân phần bên ngoài cùng đang bão hòa electron. Tổng thể electron s với electron p. Của nhân tố này là
Hướng dẫn:
Nguyên tố d bao gồm 4 lớp electron → electron sau cuối trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63d
X4s2.
Vậy tổng thể electron s cùng electron p là 20
B. Bài xích tập trắc nghiệm
Câu 1. Nguyên tử của yếu tố X bao gồm tổng số phân tử electron trong những phân lớp phường là 7. Số hạt sở hữu điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X với Y
Lời giải:
Đáp án:
Nguyên tử của yếu tắc X bao gồm tổng số phân tử electron tron những phân lớp p là 7
&r
Arr; cấu hình electron của nguyên tử X là: 1s2 2s2 2p6 3s2 3p1
&r
Arr; ZX = 13 &r
Arr; X là Al
- Số hạt có điện cảu một nguyên tử Y nhiều hơn nữa số hạt với điên của một nguyên tử X là 8 hạt &r
Arr; 2ZY - 2ZX = 8 ⇔ 2ZY – 2.13 = 8
&r
Arr; ZY = 17 &r
Arr; Y là Cl
Câu 2. yếu tắc X bao gồm Z = 28, thông số kỹ thuật electron của ion X2+ là:
A. 1s22s22p63s23p64s23d8 B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p6 4s23d6 D. 1s22s22p63s23p63d8
Lời giải:
Đáp án: D
Cấu hình electron của X là 1s22s22p63s23p63d84s2
Cấu hình ion của X2+ là 1s22s22p63s23p63d8
Câu 3. Nguyên tử của nguyên tố X có electron sống mức tích điện ở mức cao nhất là 3p. Nguyên tử của nhân tố Y cũng đều có electron sinh hoạt mức tích điện 3p và tất cả một electron ở lớp bên ngoài cùng. Nguyên tử X va Y có số electron hơn yếu nhau 3. Nguyên tử X, Y theo thứ tự là:
A. Khí hiếm và kim loại
C. Kim loại và kim loại
B. Sắt kẽm kim loại và khí hiếm
D. Phi kim cùng kim loại
Lời giải:
Đáp án: D
Cấu hình e của Y:
Arr; Y là kim loại
Ta có: ZY = 13 &r
Arr; ZX = 11 &r
Arr; Cấu hình:
&r
Arr; ZX = 15&r
Arr; Cấu hình:
Arr; X là phi kim
Câu 4. Ion Xa+ gồm tổng số hạt là 80; số hạt có điện nhiều hơn thế số phân tử không có điện là 20; tổng số hạt trong phân tử nhân của ion Xa+ là 56. Hãy đến biết thông số kỹ thuật electron đúng của Xa+?
A. <18Ar> 3d8B. <18Ar> 3d6C. <18Ar> 3d44s2D. <18Ar> 3d4
Lời giải:
Đáp án: B
Ion Xa+ gồm tổng số phân tử là 80 → 2p + n-a = 80
Ion Xa+ có số hạt mang điện nhiều hơn số hạt không có điện là 20 → (2p-a) - n = 20
Ion Xa+ tất cả tổng số hạt trong phân tử nhân là 56 → p + n = 56Giải hệ → p. = 26, n = 30, a = 2
Cấu hình của Xa+ là
Câu 5. yếu tắc A có cấu hình electron phần bên ngoài cùng là 4s1. Nhân tố B tất cả phân lớp cuối là 3p5. Viết thông số kỹ thuật electron vừa đủ của A, B. Khẳng định tên A, B.
Lời giải:
Đáp án:
cấu hình electron của A với B:
- yếu tắc A có 3 ngôi trường hợp:
+ không có electron làm việc 3d:
&r
Arr; cấu hình electron: 1s2 2s2 2p6 3s2 3p6 4s1: Z = 19 (K)
+ gồm electon ngơi nghỉ 3d: vày 4s1 chưa bão hòa nên:hoặc 3d bán bão hòa: 1s2 2s2 2p6 3s2 3p6 3d5 4s1:Z = 24 (Cr)
hoặc 3 chiều bão hòa: 1s2 2s2 2p6 3s2 3p6 3d10 4s1: Z = 29 (Cu)
- thành phần B: 1s2 2s2 2p6 3s2 3p5, B bao gồm Z = 17 là clo (Cl)
Câu 6. Nguyên tử A có e sống phân lớp 3d chỉ bằng một nửa phân lớp 4s.Cấu hình electron của nguyên tử A là
A.
Lời giải:
Đáp án: A
Số electron tối đa của phân lớp 4s là 4s2 → số e làm việc phân lớp 3d là 3d1
Cấu hình của nguyên tử A là
Câu 7. Nguyên tử M có thông số kỹ thuật electron không tính cùng là 3d74s2. Số hiệu nguyên tử của M
A. 24B. 25C. 27D. 29
Lời giải:
Đáp án: C
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27.
Câu 8. Viết cấu hình electron của những ion Cu2+, N3-, Fe3+, Cl-,Al3+. Biết số thứ tự nguyên tố theo thứ tự là: Cu (Z = 29), N (Z = 7), fe (Z = 26), Cl (Z = 17), Al (Z = 13).
... Thông số kỹ thuật electron : A 1s2 2s2 2p63s23p63d104s2 4p5 B 1s2 2s2 2p63s23p63d10 4p2 C 1s2 2s2 2p63s23p64s2 4p5 D 1s2 2s2 6 2p 3s 3p 4p Anion X - có thông số kỹ thuật electron lớp ngồi : 3s2 3p6 Ngun tố X : A ... Lớp ngồi ion 3s23p6 thông số kỹ thuật electron ngun tử khiến cho ion : A 1s2 2s2 2p6 B 1s2 2s2 2p63s23p6 C 1s2 2s2 2p63s23p64s2 D 1s2 2s2 2p63s23p1 cô giáo Thành Được www.daythem.edu.vn 20 )Một ngun tố thuộc ... Số proton , nơtron , electron ngun tử 28 thông số kỹ thuật electron ngun tử ngun tố : A 1s2 2s2 2p63s23p6 3d84s2 B 1s2 2s2 2p5 C 1s2 2s2 2p6 D 1s2 2s2 2p63s2 3p5 21 X, Y ngun tố ở trong cung đội chu kì...

... )2SO4 Chun đề II a.Tính theo CTHH: ⇔ ( O) 16 ( S ) bài xích tập cơng thức hóa học : 1: Tỡm TP% cỏc nguyờn tố theo cân nặng * cách giải: CTHH tất cả dạng Ax
By - Tìm khối lượng mol hợp chất MAx
By = x.MA ... Nhân 32 14: vào tập vừa lòng phân tử đồng sunfat (Cu
SO4) có khối lượng 160000 đv
C cho thấy tập hợp gồm ngun tử các loại Sự sinh sản thành ion (dành mang lại HSG lớp 9) Để đạt cấu trúc bão hòa ( 8e lớp ngồi 2e H ) ... CÊu t¹o nguyªn tư: KiÕn thøc c¬ b¶n ë phÇn * bài xích tập vận dụng: 1.Hợp chất A tất cả cơng thức dạng MX y M chiếm phần 46,67% trọng lượng M kim loại, X phi kim gồm lớp e ngun tử hạt nhân M gồm n – phường = phân tử nhân...

... : trong 44,8g tất cả hổn hợp X, số hiệu mol A B 0,05 mol mặt khác ngun tử khối Y > Z xác minh kim một số loại Y Z CHUN ĐỀ III BÀI TẬP VỀ PHƯƠNG TRÌNH HĨA HỌC HĨA HỌC A.LẬP PHƯƠNG TRÌNH HĨA HỌC: cách giải chung: ... + 85 ,8 = 105 ,8 (gam) 49 trung học cơ sở Lý từ Trọng BỒI DƯỠNG HSG HĨA C % H SO4 51, 48 + 24,5 = × 100% = 71 ,8% 105 ,8 Từ hỗn hợp Na
Cl mol/l, trình bày biện pháp pha chế 250 ml hỗn hợp Na
Cl 0,2 mol/l Giải phương pháp ... 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO ↑ + 4H2O RO + 2a 3Cu + a 3R H2 → 8HNO3 8a + 8HNO3 16a 2a + 8a 16a = 0, 08 ⋅1, 25 = 0,1 a = 0, 0125 + ⇔ 3 R = 40(Ca) 80 a + ( R + 16)2a = 2, a RO 2a 8a +...


Tổng đúng theo các bí quyết giải nhanh các dạng bài tập hóa học tập tự luận và trắc nghiệm ôn thi đh cực xuất xắc
... ước (Dạng tất cả kết quả) Cơng thức: n = 3n (10) MỘT SỐ CƠNG THỨC gớm NGHIỆM DÙNG GIẢI nhanh BÀI TỐN HỐ HỌC OH n = 4n OH - 3 Al - n (11) MỘT SỐ CƠNG THỨC tởm NGHIỆM DÙNG GIẢI nhanh BÀI ... Láo lếu thích hợp Y có tỉ khối so với H2 6,8 Tính công suất tổng đúng theo NH3 Ta tất cả : n
N : n
H = 1:3 8,5 M H% = - X = - = 75 % MY 13,6 MỘT SỐ CƠNG THỨC khiếp NGHIỆM DÙNG GIẢI cấp tốc BÀI TỐN HỐ HỌC HĨA VƠ CƠ I BÀI ... Lỗng dư giải phóng 0,56 lít khí NO ( đktc) tra cứu m ? Giải 56 56 ( + 0,025 ) = 2,52 gam m
Fe = ( mhỗn thích hợp + 24 n
NO ) = 80 80 MỘT SỐ CƠNG THỨC tởm NGHIỆM DÙNG GIẢI cấp tốc BÀI TỐN HỐ HỌC +) Cơng thức...
... Tên HS: ………………………………………………………………… HKI_2 013 -2 014 Cặp chất tác dụng với nhau: SGK: 1, 2/tr 6; 5/tr 11 ; 3/tr 14 ; 1/ tr 21; 2/tr 25; 3,4/tr 33; 2/tr 41; 3/tr 51; … VD1: tất cả oxit sau: SO3, Fe
O, K2O, CO2 ... 10 % dư thu 1, 12 lit khí (đktc) a Tính % chất hỗn hợp b Tính cân nặng dd HCl dùng Dạng 2: bài bác tập tăng/giảm lượng KL:SGK:6/tr 51; … SBT: 15 .7; 15 .8; 19 . 8;… VD: đến sắt có cân nặng 5,6 gam vào ... Dung dòch bao gồm màu rubi nâu d Dung dòch ko màu e Khí không màu mùi hắc, nặng trĩu KK bài toán: Dạng 1: bài xích tập láo lếu hợp: 7*/ tr 19 ; 5/tr 54; 6/ tr58; 7*/tr 69; (SGK),… VD 1: đến 10 gam tất cả hổn hợp hai...
... hàm số (1) bài đến hàm số : y = mx4 + (m2 – 9)x2 + 10 (1) (m tham số) a, Khảo giáp đổi mới thiên vẽ vật thị hàm số (1) m = b, tìm kiếm m để hàm số (1) có điểm rất trị bài xích cho hàm số y = x3 – 3x2 + m (1) ... Diện tích mang lại hàm số y = 4x3 – 6x2 + bài xích 13 (1) a, Khảo tiếp giáp đổi thay thiên vẽ vật dụng thị hàm số (1) b, Viết phương trình tiếp con đường đồ vật thị hàm số (1) , biết tiếp tuyến đường qua điểm M( -1; -9) bài xích 14 đến hàm số ... Châu bài 44 đến hàm số y = BÀI TẬP 12 CHƯƠNG 2x + (1) x +1 Khảo sát phát triển thành thiên vẽ thiết bị thị hàm số (1) Viết phương trình tiếp con đường d thiết bị thị hàm số (1) , biết d vuông góc với đường thẳng y = x + Bài...
... T ca Clo, Oxi, Natri v Hiro ln lc l 17 ; 8; 11 v Hóy xột xem kớ hiu 36 16 23 na no sau õy khụng ỳng A 17 Cl B O C 11 D 21 H Cõu 7: Nhn nh kớ hiu 12 25 X v 25 11 Y Cõu tr li no ỳng cỏc cõu tr li ... Cõu 10 : nhì nguyờn t X v Y thuc chu k 3, iu kin thng u l cht rn bit 8 ,1 gam X cú s mol nhiu tp hà nội 4,8 gam Y l 0 ,1 mol v MX MY = X v Y ln lc l A đắm say v mãng cầu B Al v Mg C Mg v Al D Be v Li Cõu 11 : Tng ... Nguyờn t, s cỏc ng v tỡm nguyờn t trung bỡnh v ngc li 40 36 38 Cõu 1: Nguyờn t argon cú ng v: 18 Ar (99,63%); 18 Ar (0, 31% ); 18 Ar (0,06%) Xỏc nh nguyờn t trung bỡnh ca Ar A 39,98 B 24,6 C 50,4...
... F 2CHCH + mol + Hg H2O xt (đime hóa) 600 C, xt (trime hóa) g 3CHCH Cõu 11 Vit PTHH iu ch cỏc cht sau t cỏc mono me tng ng - 18 - TON B CC CHUYấ
N Hể
A HC 11 Axetilen, vinyl clorua, benzen, ... V gi tờn chỳng theo tờn nạm th Cõu Gi tờn cỏc andehit sau theo danh phỏp thng: - 26 - TON B CC CHUYấ
N Hể
A HC 11 HCHO, CH3CHO, CH3CH2CHO, CH2=CHCHO Cõu Gi tờn cỏc andehit sau theo danh phỏp ... Lớt tp hà nội hp khớ C2H4 v C3H6 (ktc) thu c 11, 2 lớt khớ CO2 (ktc) a Xỏc nh % theo th tớch mi khớ tp hà nội hp u b Tớnh lng nc sinh Cõu 36 Mt hà nội hp gm nhị anken cú th tớch 11, 2 lớt (ktc) k tip dóy ng ng Khi...
... Trang IV – Hóa trị: Hóa trị nguyên tố phụ thuộc hiđro bao gồm hóa trị I, oxi gồm hóa trị II phép tắc hóa trị: gồm CTHH Ax
By biết hóa trị A a, hóa trị B b ta có: a x = b y Vận dụng: a) Tính hóa trị nguyên ... bài 3: Hãy cho biết thể tích khí đktc của: a) 3,3 g N2O; 95, 48 g CO2; 0,5 N phân tử SO2 b) các thành phần hỗn hợp khí gồm: 0, 08 N phân tử CO2; 0,09 N phân tử NH3 c) các thành phần hỗn hợp khí gồm: 0 ,88 g CO2; 0, 68 g NH3 bài xích ... Luyện tập chương 4: bài xích 1: hoàn thành phản ứng hóa học sau: T0 a) …… + …… Mg
O T0 b) …… + …… T0 P2O5 c) …… + …… Al2O3 T0 d) KCl
O3 …… + …… Điện phân e) H2O …… + …… bài bác 2: a) xác định công thức hóa học...
tự khóa: các dạng bài bác tập hóa 10 chương halogencác dạng bài xích tập hóa 10 chương oxi lưu lại huỳnhcác dạng bài tập hóa 8 chương 1các dạng bài tập hóa 11 chương 1các dạng bài bác tập hóa 10 chương 4các bài bác tập hóa 10 chương 1các dạng bài xích tập hóa 10 học kì 1các dạng bài tập lý 12 chương 1cách giải những dạng bài bác tập hóa 10cách giải bài xích tập hóa 10 chương 1các dạng bài tập thứ lý chương 1 lớp 12bai tap hoa 10 chuong 1de bai tap hoa 10 chuong 1bai tap hoa 10 chuong 1 haydang bai tap hoa 11 chuong 1Nghiên cứu tổ chức pha chế, tiến công giá quality thuốc tiêm truyền trong đk dã ngoại
Nghiên cứu vãn vật liệu đổi khác (metamaterials) hấp thụ sóng điện tử ở vùng tần số THz
Biện pháp làm chủ hoạt hễ dạy hát xoan vào trường trung học cơ sở huyện lâm thao, phú thọ
Giáo án Sinh học tập 11 bài 13: thực hành phát hiện tại diệp lục cùng carôtenôit
ĐỒ ÁN NGHIÊN CỨU CÔNG NGHỆ KẾT NỐI VÔ TUYẾN CỰ LY XA, CÔNG SUẤT THẤP LPWANQuản lý hoạt động học tập của học viên theo phía phát triển khả năng học tập hợp tác và ký kết tại các trường phổ thông dân tộc bản địa bán trú huyện cha chẽ, tỉnh quảng ninh
Nghiên cứu về quy mô thống kê học tập sâu và áp dụng trong dìm dạng chữ viết tay hạn chếNghiên cứu tổng hợp các oxit các thành phần hỗn hợp kích thƣớc nanomet ce 0 75 zr0 25o2 , ce 0 5 zr0 5o2 và điều tra hoạt tính quang đãng xúc tác của chúng
Định tội danh từ trong thực tiễn huyện bắt buộc Giuộc, thức giấc Long An (Luận văn thạc sĩ)Thiết kế và chế tạo mô hình biến chuyển tần (inverter) đến máy ổn định không khí
Chuong 2 thừa nhận dạng rui ro
Quản lý nợ xấu tại Agribank chi nhánh huyện Phù Yên, tỉnh tô La (Luận văn thạc sĩ)BT Tieng anh 6 UNIT 2Tăng trưởng tín dụng hộ sản xuất nntt tại ngân hàng Nông nghiệp và cải cách và phát triển nông thôn việt nam chi nhánh tỉnh Bắc Giang (Luận văn thạc sĩ)Tranh tụng tại phiên tòa hình sự xét xử sơ thẩm theo điều khoản tố tụng hình sự nước ta từ thực tiễn xét xử của các Tòa án quân sự chiến lược Quân quần thể (Luận văn thạc sĩ)Chiến lược kinh doanh tại bank Agribank chi nhánh thành phố sài thành từ 2013-2015Đổi mới thống trị tài chính trong vận động khoa học tập xã hội trường phù hợp viện hàn lâm kỹ thuật xã hội việt nam
HIỆU QUẢ CỦA MÔ HÌNH XỬ LÝ BÙN HOẠT TÍNH BẰNG KIỀMQUẢN LÝ VÀ TÁI CHẾ NHỰA Ở HOA KỲ
Tai lieu Mục lục nội dung bài viết Tìm kiếm bắt đầu Luận Văn Tài liệu bắt đầu Chủ đề bài liệu mới đăng pk với cối xay gió ngữ văn 8 đã từng em cùng cha mẹ đi thăm mộ người thân trong gia đình trong ngày lễ tết đặc điểm chung với vai trò của ngành ruột khoang thuyết minh về bé trâu lập dàn ý bài văn từ bỏ sự lớp 10 giải bài bác tập thứ lý 8 chuyện cũ trong lấp chúa trịnh giải bài xích tập đồ lý 9 soạn văn tế nghĩa sĩ yêu cầu giuộc soạn bài xích cô nhỏ nhắn bán diêm giai bai tap vat ly 8 viet bai tap lam van so 2 lop 9 thuyet minh ve con trau bài bác ca ngắn đi trên bãi cát sự cải cách và phát triển của từ vựng tiếp theo ôn tập văn học tập trung đại việt nam lớp 11 bài bác tập xác suất thống kê có giải thuật bai viet so 2 lop 9 de 1 soan bai teo be ban diem gàn van lop 8 phân tích bài bác thơ từ tình 2








