Mời quý thầy cô và các em học sinh cùng xem thêm Đề thi online học tập kì II môn Hóa lớp 10 của các trường THPT khác biệt trên cả nước, bộ tài liệu nhằm phục vụ cho công tác giảng dạy của quý thầy cô và nhu yếu học tập, ôn luyện của các em học sinh sẵn sàng bước vào kì thi học tập kì. Xem thêm tài liệu để các em nuốm vững những kiến thức về oxi, ozon, lưu giữ huỳnh, axit sunfuric, clohidric, hợp chất tất cả oxi của clo....HOC247 hy vọng tài liệu này sẽ giúp các em đạt kết quả cao vào kì thi chuẩn bị tới!
Trắc nghiệm online học tập kì 2 lớp 10 môn
Hóa họcnăm 2022 (Thi online)
Phần này các em được làm bài thi online nhằm kiểm tra năng lực của mình, sau đó đối chiếu hiệu quả và xem đáp án chi tiết từng câu hỏi. Bạn đang xem: Đề thi học kì 2 môn hóa lớp 10
Đề thi học kì 2 lớp 10 môn hóa học năm 2022 (Tải File)
Phần này những em hoàn toàn có thể xem online hoặc download file đề thi về tìm hiểu thêm gổm đầy đủ câu hỏi và giải đáp làm bài.
Trắc nghiệm online học tập kì 2 lớp 10 môn
Hóa họcnăm 2021 (Thi online)
Phần này các em được gia công bài thi online nhằm kiểm tra năng lượng của mình, tiếp đến đối chiếu hiệu quả và xem đáp án chi tiết từng câu hỏi.
Đề thi học tập kì 2 lớp 10 môn hóa học năm 2021 (Tải File)
Phần này các em hoàn toàn có thể xem online hoặc sở hữu file đề thi về xem thêm gổm đầy đủ thắc mắc và đáp án làm bài.
Trắc nghiệm online học tập kì 2 lớp 10 môn Hóa năm 2020 (Thi online)
Phần này những em được thiết kế trắc nghiệm online để kiểm tra năng lực và tiếp nối đối chiếu hiệu quả và xem đáp án cụ thể từng câu hỏi.
Đề thi học kì 2 lớp 10 môn
Hóa năm 2020 (Tải File)
Phần này những em rất có thể xem online hoặc cài đặt file đề thi về tham khảo gổm đầy đủ câu hỏi và lời giải làm bài.
Trắc nghiệm online học tập kì 2 lớp 10 môn Hóa năm 2019 (Thi online)
Phần này các em được làm trắc nghiệm online để kiểm tra năng lực và tiếp đến đối chiếu tác dụng và xem đáp án chi tiết từng câu hỏi.
Đề thi học tập kì 2 lớp 10 môn
Hóa năm 2019 (Tải File)
Phần này các em rất có thể xem online hoặc cài đặt file đề thi về xem thêm gổm đầy đủ thắc mắc và câu trả lời làm bài.
Trắc nghiệm online học kì 2 lớp 10 môn
Hóa năm 2018 (Thi online)
Tổng hợp các đề thi trắc nghiệm online năm 2018 các em rất có thể làm để tham khảo thêm
Đề thi học kì 2 lớp 10 môn
Hóa năm 2018 (Tải File)
Tổng hợp những file để thi các em hoàn toàn có thể tải về để tham khảo thêm
Trên đây là một số đề thi HK2 môn Hóa lớp 10 được tổng thích hợp từ những trường thpt Chuyên, không siêng trên cả nước. Những em hoàn toàn có thể thi theo hình thức online để review năng lực của mình hoặc download về máy.
Ngoài ra những em gồm thể chia sẻ lên Facebook cho bằng hữu cùng học nhằm tích lũy điểm HP với nhận đa số quà giá trị từ HOC247 nhé! Chúc những em học tập tốt!
Lớp 1Đề thi lớp 1
Lớp 2Lớp 2 - kết nối tri thức
Lớp 2 - Chân trời sáng sủa tạo
Lớp 2 - Cánh diều
Tài liệu tham khảo
Lớp 3Lớp 3 - kết nối tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu tham khảo
Lớp 4Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Lớp 5Sách giáo khoa
Sách/Vở bài tập
Đề thi
Lớp 6Lớp 6 - kết nối tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 7Lớp 7 - kết nối tri thức
Lớp 7 - Chân trời sáng sủa tạo
Lớp 7 - Cánh diều
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 8Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 9Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng tạo
Lớp 10 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 11Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 12Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
ITNgữ pháp giờ đồng hồ Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Bộ đề thi chất hóa học 10Bộ đề thi chất hóa học lớp 10 - kết nối tri thức
Bộ đề thi hóa học lớp 10 - Cánh diều
Bộ đề thi hóa học lớp 10 - Chân trời sáng tạo
Đề thi hóa học 10 học tập kì 2 bao gồm đáp án (5 đề)
Trang trước
Trang sau
Dưới đó là danh sách Đề thi chất hóa học 10 học tập kì 2 tất cả đáp án (5 đề). Mong muốn bộ đề thi này sẽ giúp bạn ôn luyện và đạt điểm cao trong những bài thi môn hóa học lớp 10.
Đề thi hóa học 10 học kì 2 có đáp án (5 đề)
Bài giảng: Đề thi học kì 2 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
Đề thi học tập kì 2 - Trắc nghiệm + từ bỏ luận
Phòng giáo dục đào tạo và Đào chế tác .....
Đề thi học kì 2
Môn: chất hóa học 10
Thời gian làm cho bài: 45 phút
(Đề 1)
Bài giảng: Đề thi học kì 2 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên Viet
Jack)
đến nguyên tử khối của những nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Cl2 không phản ứng trực tiếp được với chất nào sau đây?
A. O2. B. H2. C. Cu. D. Na
OH.
Câu 2: Trong những halogen sau, halogen nào gồm tính khử yếu nhất?
A. Flo. B. Clo. C. Brom. D. Iot.
Câu 3: Cho 4,35 gam Mn
O2 công dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít. B. 1,12 lít. C. 2,24 lít. D. 0,112 lít.
Câu 4: Nguyên tố sulfur không có công dụng thể hiện số lão hóa là
A. +4. B. +6. C. 0. D. +5.
Câu 5: Chất nào tiếp sau đây không tác dụng với dung dịch HCl, H2SO4 loãng?
A. Cu
O. B. Na
OH. C. Fe. D. Ag.
Câu 6: Trong phòng thí nghiệm, bạn ta thường pha trộn oxi bằng cách
A. nhiệt độ phân KMn
O4.
B. nhiệt phân K2Mn
O4.
C.
Xem thêm: 5 cách trang trí bánh kem đơn giản, đẹp, dễ thương cùng bé yêu
điện phân nước.D. chưng chứa phân đoạn không khí lỏng
Câu 7: Dẫn 2,24 lít SO2 (đktc) vào hỗn hợp nước vôi trong, dư. Cân nặng kết tủa tạo thành thành sau bội phản ứng là
A. 10 gam. B. 11 gam. C. 12 gam. D. 13 gam.
Câu 8: Trường thích hợp nào tác dụng với H2SO4 sệt nóng với H2SO4 loãng mọi cho thành phầm giống nhau?
A. Fe. B. Fe(OH)2. C. Fe(OH)3. D. Fe3O4.
Câu 9: Hòa tan trọn vẹn 0,65 gam Zn bởi dung dịch H2SO4 đặc, nóng, dư thấy chiếm được V lít SO2 (đktc). Cực hiếm của V là
A. 0,224. B. 0,336. C. 0,112. D. 0,448.
Câu 10: Cho cân bằng hóa học: 2SO2 (k) + O2 (k)&h
Arr;2SO3 (k); làm phản ứng thuận là bội nghịch ứng lan nhiệt. Phát biểu đúng là
A. cân nặng bằng di chuyển theo chiều thuận khi tăng nhiệt độ độ.
B. cân bằng chuyển dịch theo chiều nghịch khi sút nồng độ O2.
C. cân nặng bằng chuyển dịch theo chiều thuận khi sút áp suất hệ phản bội ứng.
D. cân nặng bằng chuyển dời theo chiều nghịch khi giảm nồng độ SO3.
II. Từ luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình phản ứng xảy ra trong các trường thích hợp sau:
1/ cho Cl2 tác dụng với KOH ở nhiệt độ 90ºC.
2/ mang lại S công dụng với O2
3/ đến dd HCl tính năng với KOH
4/ mang đến Fe
O công dụng với H2SO4 đặc.
Câu 2 ( 1 điểm): ): mang lại phản ứng: Br2 + HCOOH → 2HBr + CO2. Nồng độ ban sơ của Br2 là 0,012 mol/lít, sau 50 giây nồng độ Br2 sót lại là a mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Tính quý hiếm của a.
Câu 3( 2 điểm): mang lại 3,68 gam lếu láo hợp tất cả Al với Zn tác dụng với một số lượng vừa dùng dung dịch HCl 10%, nhận được 2,24 lít khí H2 (ở đktc).
a/ xác minh % trọng lượng mỗi sắt kẽm kim loại trong các thành phần hỗn hợp ban đầu.
b/ Tính mật độ % các muối gồm trong dung dịch sau bội phản ứng.
Câu 4 ( 2 điểm): Hoà tan hoàn toàn 2,44 gam các thành phần hỗn hợp bột X bao gồm Fex
Oy với Cu bằng dung dịch H2SO4 đặc nóng (dư). Sau bội phản ứng chiếm được 0,504 lít khí SO2 (sản phẩm khử duy nhất, sống đktc) với dung dịch chứa 6,6 gam tất cả hổn hợp muối sunfat. Tính phần trăm cân nặng của Cu vào X.
Đáp án và chỉ dẫn giải
I. Trắc nghiệm ( 0,3 điểm/1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | A | B | D | D | A | C | C | A | B |
Câu 1: Cl2 ko phản ứng trực tiếp được cùng với O2. Chọn lời giải A.
Câu 2: Halogen gồm tính khử yếu tốt nhất là Flo. Chọn câu trả lời A.
Câu 3:
Mn
O2 + 4HCl → Mn
Cl2 + Cl2 + H2O
0,050,05(mol)
→ V = 0,05.22,4 = 1,12 lít. Chọn lời giải B.
Câu 4: yếu tắc S không có công dụng thể hiện tại số oxi hóa là +5. Chọn câu trả lời D.
Câu 5: Ag không chức năng với hỗn hợp HCl, H2SO4 loãng. Chọn lời giải D.
Câu 6: Trong chống thí nghiệm, fan ta thường pha chế oxi bằng phương pháp nhiệt phân KMn
O4. Chọn đáp án A.
Câu 7:
SO2 + Ca(OH)2 dư → Ca
SO3 + H2O
0,10,1(mol)
→ m↓ = 0,1. 120 = 12 gam. Chọn giải đáp C.
Câu 8:
2Fe(OH)3 + 3H2SO4 loãng → Fe2(SO4)3 + 6H2O
2Fe(OH)3 + 3H2SO4 đặc → Fe2(SO4)3 + 6H2O. Chọn giải đáp C
Câu 9: Áp dụng định khí cụ bảo toàn e có nkhí = n
Zn = 0,01 → Vkhí = 0,01.22,4 = 0,224 lít. Chọn giải đáp A.
Câu 10: Phát biểu đúng là: cân nặng bằng chuyển dời theo chiều nghịch khi bớt nồng độ O2. Chọn câu trả lời B.
II. Trường đoản cú luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng từng PT 0,5 điểm, thiếu thăng bằng trừ 1/2 số điểm từng PT
1/ 3Cl2 + 6KOH →(90ºC) 5KCl + KCl
O3 + 3H2O
2/ S + O2 → SO2
3/ HCl + KOH → KCl + H2O
4/ 2Fe
O + 4H2SO4 sệt → Fe2(SO4)3 + SO2 + 4H2O
Câu 2 ( 1 điểm):
Áp dụng công thức: (0,5 điểm)
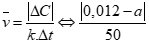
=4.10-5
Giải PT được a = 0,01 (thỏa mãn) hoặc a = 0,014 > 0,012 (loại) (0,5 điểm)
Câu 3 ( 3 điểm):
2Al + 6HCl → 2Al
Cl3 + 3H2(0,25 điểm)
x 1,5x(mol)
Zn + 2HCl → Zn
Cl2 + H2(0,25 điểm)
y y (mol)
Tính mol khí H2 = 0,1 mol, hotline số mol Al và Zn theo thứ tự là x, y (0,25 điểm)
Lập hệ:(0,25 điểm)
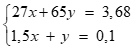
Giải hệ được x = 0,04 mol; y = 0,04 mol
tính %m
Al =
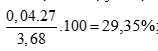
%m
Zn = 100 – 29,35 = 70,65%
Tính được số mol HCl = 0,2 mol; mdd HCl = 73 (gam)(0,25 điểm)
→ m dd sau pư = m dd HCl + m sắt kẽm kim loại – mkhí = 3,68 + 73 – 0,2 = 76,48 gam
C%Al
Cl3 = (0,25 điểm)








