Tổng hợp các công thức hóa học lớp 11 là việc quan trọng đặc biệt mà teen 2K1 cần thực hiện trước thềm năm học tập mới. Nỗ lực chắc những công thức này, học viên sẽ tiện lợi tiếp thu được kỹ năng mới. Đến ngay sát kì thi các em sẽ chưa hẳn mất thời hạn tổng vừa lòng lại mà chỉ việc tập trung ôn thi. Vậy nên sẽ cải thiện được tối đa tác dụng học tập. Bạn đang xem: Các công thức hóa học cần nhớ lớp 11

Các công thức hóa học lớp 11 trung tâm nhất
HỌC HÓA CÙNG INFOGRAPHIC CÁN ĐÍCH ĐIỂM 9,10 THI trung học phổ thông QUỐC GIA
Tổng hợp những công thức hóa học lớp 11 kì I
Ở kì I môn Hóa học, các em đã làm được học những kiến thức liên quan đến: Sự điện li, nitơ-photpho và Cabon-Silic. Bây giờ chúng ta vẫn lần lượt hệ thống lại đa số công thức đặc biệt quan trọng trong từng phần.
Phần 1: Sự năng lượng điện li
Phần năng lượng điện li là một trong những phần hay mở ra trong đề thi THPT tổ quốc môn chất hóa học nhất. Cũng chính vì vậy, có một số công thức mà bất kể học sinh nào cũng phải nhớ.
Hằng số năng lượng điện li được vận dụng cho sự phân li yếu. Nếu chất điện li yếu tất cả công thức Aa
Bb thì công thức phân li trong hỗn hợp như sau:
Aa
Bb a
An+b
Bm-
Khi đó cách làm tính hằng số điện li sẽ được tính như sau:
K=
Trong đó: a.n = b.m
Hằng số phân li của axit với bazơ yếu
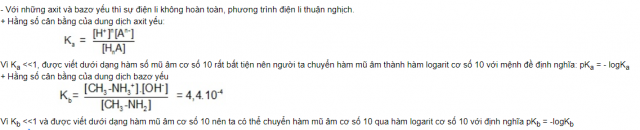
Mối quan hệ tình dục giữa hằng số điện li với độ điện li α
Xét hóa học điện li yếu HA tất cả nồng độ thuở đầu là
Co và độ điện li α
Phần 2: Nitơ- Photpho
Tổng hợp các công thức chất hóa học lớp 11 phần Nitơ và hợp hóa học của Nitơ.
- công thức điều chế Nitơ
NH4NO2 →t° N2 + 2H2O
NH4Cl + Na
NO2 →t° N2 + Na
Cl + 2H2O
Công thức điều chếNH3
NH4+ + OH- → NH3↑+ H2O
Các cách làm hóa học liên quan đến hợp hóa học của NitơAxit Nitric : HNO3
HNO3 ko bền khi gồm ánh sách đã phân hủy một phần tạo thành NO2. Ta có công thức phân diệt sau.
4HNO3 →4NO2 + O2 + 2H2O
Bên cạnh đó các em cần đặc biệt nhớ đặc điểm của HNO3 khi công dụng với kịm loại. Hợp hóa học của Nitơ này hoàn toàn có thể oxi hóa phần lớn các kim loại ngoại trừ Au và Pt.
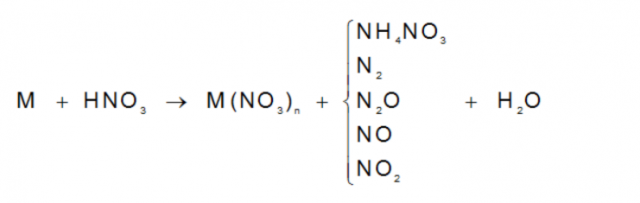
Muối amoni
NH4+ và
NO3-
Một số công thức hóa học quan trọng

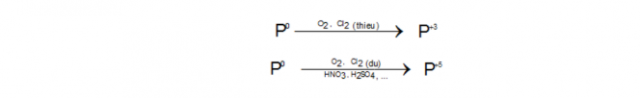
Tính oxi hóa:
Tính khử:
Axit phophoric:
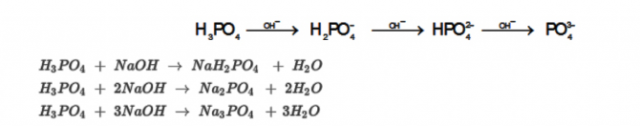
Phản ứng thủy phân của muối bột Photphat
PO43- + H2O↔ HPO42- + OH-
H2PO4- + H2O↔ H3O+ + HPO42-
Phần 3: Cacbon - Silic
Cacbon
Tính lão hóa của Cacbon khi tính năng với:
Hidro:C+ 2H2 →(tº, xt) CH4Kim loại:Al + C→ (t°) Al4C3Hợp chất của cabon và những công thức hóa học bắt buộc nhớ.Cacbonđioxit (CO2)
Phản ứng với hỗn hợp kiềm:
CO2 + OH-→ HCO3-
CO2 + 2OH-→ CO32- + H2O
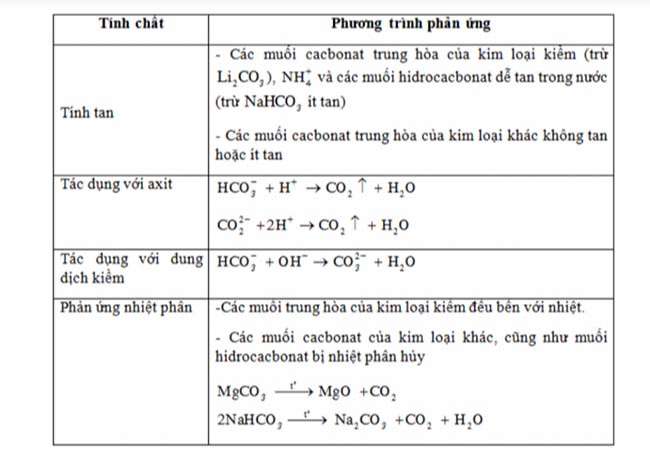
Muối cacbonat
CO2 phản ứng với dung dịch kiệm tạo ra 2 muối bột HCO3- và
CO32-
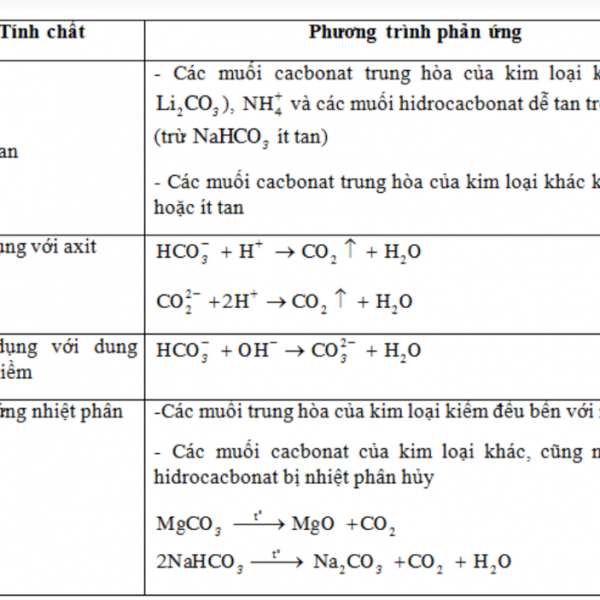
Silic và những hợp chất của silic
Công thức hóa học về tính chất khwr cùng tính lão hóa của silic
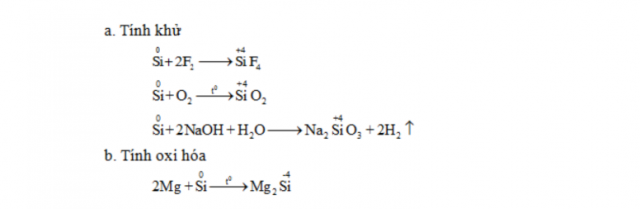
Trên đấy là tổng hợp các công thức chất hóa học lớp 11 kì I nhưng mà CCBook vẫn tổng hòa hợp lại giúp các em. Những bí quyết này phần đa là nhữ cách làm cơ bản và hết sức quan trọng. Để không quăng quật lỡ bất kể câu hỏi như thế nào trong đề thi THPT quốc gia thì những em hãy nỗ lực ghi ghi nhớ chúng. Làm bài tập thật nhiều cũng là phương pháp để học thuộc công thức hóa học hiệu quả.
Tổng hợp các công thức chất hóa học lớp 11 kì II
Ở kì II môn hóa học lớp 11, học viên được tiếp cận với kỹ năng và kiến thức về hóa hữu cơ. Đây chính là nền tảng để các em hoàn toàn có thể học những kiến thức và kỹ năng hóa học tập 12 mới.
Xem thêm: Cách kiểm tra đồng hồ skagen chính hãng chỉ trong 3 phút, cách phân biệt đồng hồ skagen chính hãng
Ở phần này có khá nhiều công thức chất hóa học mà học sinh cần bắt buộc ghi nhớ. CCBook xin gửi đến các em TỔNG HỢP CÁC CÔNG THỨC HÓA HỌC LỚP 11 PHẦN HỮU CƠđầy đầy đủ nhất.
Tài liệu bao gồm các bí quyết quan trọng cũng tương tự cách vận dụng để giải nhanh bài tập trắc nghiệm. Chính vì như thế đây là một trong tài liệu rất bổ ích cho teen 2K1 ôn tập trước thềm năm học mới.
Sách hỗ trợ tổng hợp các công thức chất hóa học lớp 11 đầy đủ, chi tiết nhất

Cuốn sách hệ thống các kiến thức và kỹ năng Hóa học trọng tâm của cả 3 năm học
Cuốn sách vừa hệ thống lại định hướng vừa hệ thống các dạng bài bác tập giữa trung tâm của năm 11 cùng lớp 10 chắc hẳn rằng sẽ được teen 2K1 qúy như vàng. Biết được sự ý muốn mỏi của những em, CCBook đã xuất bản cuốn sách luyện thi THPT đất nước môn Hóa học. Cuốn sách cùng với tên đầy đủ là Đột phá 8+ kì thi THPT giang sơn môn Hóa học.
Đây là cuốn sách trước tiên trên thị phần tổng hợp kỹ năng cả 3 năm 10,11 cùng 12. Kỹ năng lớp 10,11 được cô ứ về cả triết lý và bài bác tập. Những em rất có thể tìm thấy toàn bộ các dạng công thức tương tự như bài tập trung tâm tại đây. Hơn nữa phần kiến thức Hóa học lớp 12 được trình bày trong sách rất cụ thể và nạm thể. Học tập sinh rất có thể tự có tác dụng quen với kiến thức và kỹ năng mới ngay cả khi chưa bước vào năm học chính thức.
Sở hữu cuốn sách Đột phá 8+ kì thi thpt Quốc gia, teen 2K1 sẽ giống hệt như "hổ mọc thêm cánh". Những em sẽ dễ dàng vượt qua kì thi THPT nước nhà sắp tới giả dụ biết áp dụng sách hiệu quả.
Tổng hợp những công thức chất hóa học vô cơ lớp 11Điện lyHằng số axit, hằng số bazơp
H của dung dịch, chất chỉ thị màu
Phản ứng thương lượng ion vào dung dịch hóa học điện li Nitơ- Photpho Photpho Cacbon – Silic
Công thức chất hóa học hữu cơ lớp 11Chủ đề lập bí quyết phân tử hợp hóa học hữu cơ
Lập cách làm phân tử hóa học hữu cơ
Tổng hợp những công thức chất hóa học vô cơ lớp 11
Điện ly
Dung dịch



Dựa theo độ điện li ta phân một số loại thành 2 các loại chất điện li



Hằng số axit, hằng số bazơ
Hằng số axit

p
H của dung dịch, chất chỉ thị màu

H, độ p
H trong các môi trường


H của dung dịch


Đối với axit yếu, bazơ yếu



H đệm của dung dịch



Phản ứng trao đổi ion vào dung dịch chất điện li



Cách biểu diễn phương trình bên dưới dạng phân tử với ion




H dung dịch khi pha loãng bằng nước


Nitơ- Photpho
Tổng hợp những công thức hóa học lớp 11 phần Nitơ với hợp hóa học của Nitơ.
– công thức điều chế Nitơ
NH4NO2 →t° N2+ 2H2O
NH4Cl + Na
NO2 →t° N2+ Na
Cl + 2H2O
Công thức điều chếNH3
NH4++ OH– → NH3↑+ H2O
Các công thức hóa học tương quan đến hợp chất của NitơAxit Nitric : HNO3
HNO3 ko bền khi bao gồm ánh sách vẫn phân hủy một trong những phần tạo thành NO2. Ta có công thức phân diệt sau.
4HNO3→4NO2+ O2+ 2H2O
Bên cạnh đó những em cần quan trọng nhớ tính chất của HNO3 khi công dụng với kịm loại. Hợp chất của Nitơ này rất có thể oxi hóa hầu hết các sắt kẽm kim loại ngoại trừ Au với Pt.
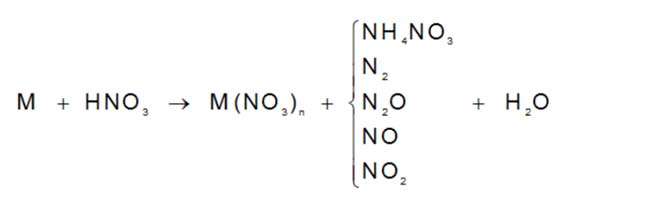
Muối amoni
NH4+ và
NO3–
Một số công thức hóa học quan trọng
Photpho
Tính oxi hóa: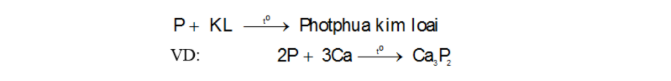
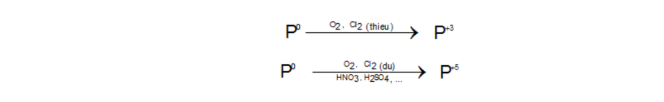
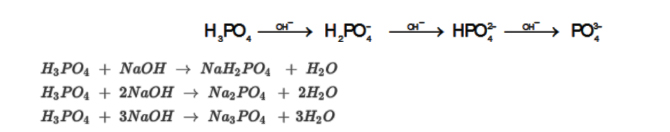
PO43-+ H2O↔ HPO42-+ OH–
H2PO4–+ H2O↔ H3O++ HPO42-
Cacbon – Silic
CacbonTính thoái hóa của Cacbon khi công dụng với:
Hidro:C+ 2H2→(tº, xt) CH4Kim loại:Al + C→ (t°) Al4C3Hợp chất của cabon và những công thức hóa học đề xuất nhớ.Cacbonđioxit (CO2)Phản ứng với hỗn hợp kiềm:
CO2+ OH–→ HCO3–
CO2+ 2OH–→ CO32-+ H2O
Muối cacbonatCO2 phản bội ứng với dung dịch kiệm tạo thành 2 muối HCO3– và
CO32-
Công thức hóa học về tính khwr cùng tính thoái hóa của silic
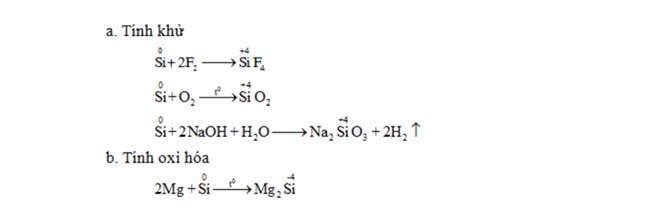
✅ PHƯƠNG PHÁP HỌC TỐT MÔN HÓA
Công thức chất hóa học hữu cơ lớp 11
Xác định thành phần thành phần (m, %)


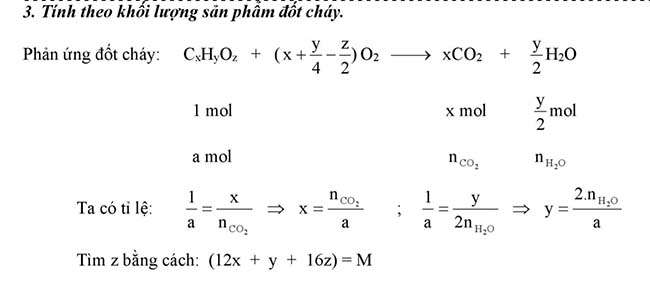
Chủ đề lập phương pháp phân tử hợp chất hữu cơ
Xác định thành phần xác suất khối lượng

Lập phương pháp phân tử hóa học hữu cơ
Dựa vào phần trăm cân nặng các nguyên tố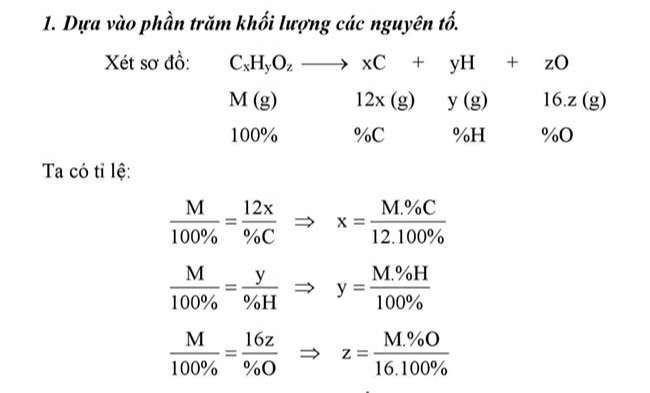

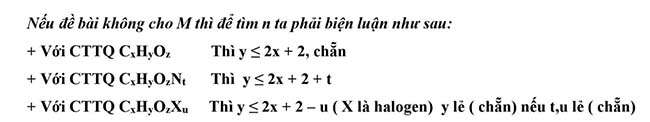

✅ CÔNG THỨC TOÁN 12 ⭐️⭐️⭐️⭐️⭐️








